Gambar struktur Lewis dari senyawa CH3NH2
Mapel Kimia, Jenjang Sekolah Menengah Atas
Gambar struktur Lewis dari senyawa CH₃NH₂ adalah
Pendahuluan
Struktur Lewis merupakan diagram yang menggambarkan ikatan kimia antara atom dalam suatu molekul. Struktur itu juga menampilkan jumlah total pasangan elektron yang ada di masing-masing atom yang membentuk molekul. Dalam struktur Lewis, setiap titik mewakili elektron dan sepasang titik di antara simbol unsur/atom mewakili ikatan.
Jenis ikatan kimia antar atom dan hubungannya dengan selisih elektronegativitas antar atom :
Terkait kestabilan konfigurasi elektron :
- Aturan oktet menyatakan bahwa unsur-unsur kimia yang berikatan cenderung memiliki delapan elektron dalam kulit terluarnya (mengikuti gas mulia yang stabil).
- Aturan duplet menyatakan bahwa unsur-unsur kimia yang berikatan cenderung memiliki dua elektron dalam kulit terluarnya (mengikuti gas mulia He yang stabil).
Daftar Isi
Pembahasan
1. Elektron valensi masing-masing unsur
- Dari tabel periodik unsur :
Nomor atom C = 6
Nomor atom H = 1
Nomor atom N = 7 - Elektron valensi unsur :
C = 2.4 ==> elektron valensi 4
H = 1 ==> elektron valensi 1
N = 2.5 ==> elektron valensi 5
2. Jenis ikatan
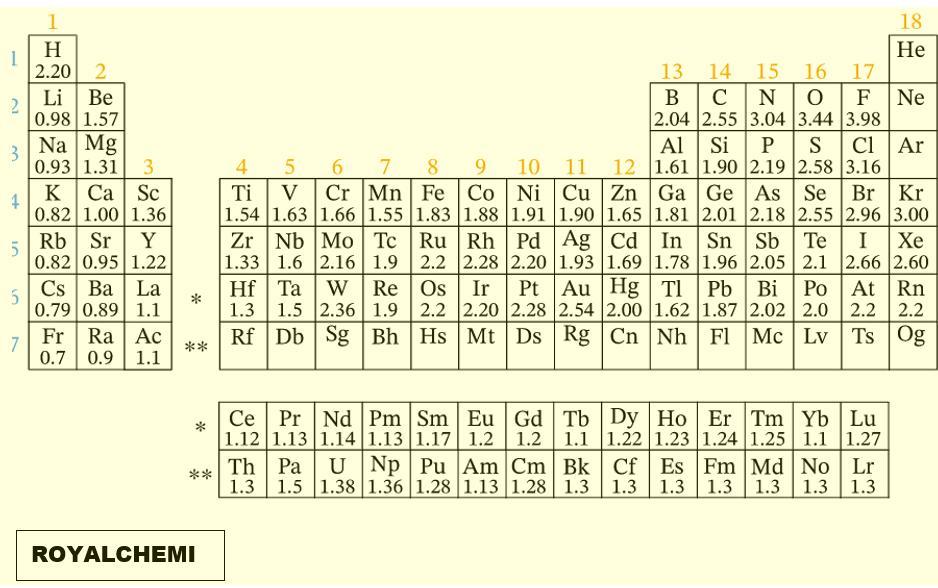
- Selisih elektronegativitas : (Cek Tabel pada lampiran)
C-H : 2.55 – 2.20 = 0.35 ==> kovalen non polar
C-N : 3.04 – 2.55 = 0.49 ==> kovalen non polar
N-H : 3.04 – 2.20 = 0.84 ==> kovalen polar - Ikatan antara C-H, N-H, dan H-N adalah ikatan kovalen.
3. Penentuan ikatan dan penggambaran
- Atom N dan C merupakan atom dengan kebutuhan elektron besar ==> dibuat ikatan dulu ==> ikatan kovalen non polar
- Kemudian, karena N masih perlu 2 elektron maka perlu mengikat 2 elektron dari 2 unsur H. (N ikut oktet dan H ikut duplet). Adapun C kurang 3 elektron, maka perlu mengikat 3 elektron dari 3 unsur H. (C ikut oktet dan H ikut duplet).
Pelajari lebih lanjut
- Materi tentang struktur lewis BeCl₂:
- Materi tentang definisi struktur lewis :
- Materi tentang struktur lewis unsur S :
______________
Detail jawaban
Kelas : X
Mapel : Kimia
Bab : Ikatan kimia
Kode : 10.7.4
#SolusiBrainlyCommunity
Pertanyaan Baru di Kimia
Gambar struktur Lewis dari senyawa CH3NH2

Kimia, Sekolah Menengah Atas
Gambar struktur Lewis dari senyawa CH₃NH₂ adalah
Pendahuluan
Struktur Lewis merupakan diagram yang menggambarkan ikatan kimia antara atom dalam suatu molekul. Struktur itu juga menampilkan jumlah total pasangan elektron yang ada di masing-masing atom yang membentuk molekul. Dalam struktur Lewis, setiap titik mewakili elektron dan sepasang titik di antara simbol unsur/atom mewakili ikatan.
Jenis ikatan kimia antar atom dan hubungannya dengan selisih elektronegativitas antar atom :
Terkait kestabilan konfigurasi elektron :
- Aturan oktet menyatakan bahwa unsur-unsur kimia yang berikatan cenderung memiliki delapan elektron dalam kulit terluarnya (mengikuti gas mulia yang stabil).
- Aturan duplet menyatakan bahwa unsur-unsur kimia yang berikatan cenderung memiliki dua elektron dalam kulit terluarnya (mengikuti gas mulia He yang stabil).
Pembahasan
1. Elektron valensi masing-masing unsur
- Dari tabel periodik unsur :
Nomor atom C = 6
Nomor atom H = 1
Nomor atom N = 7 - Elektron valensi unsur :
C = 2.4 ==> elektron valensi 4
H = 1 ==> elektron valensi 1
N = 2.5 ==> elektron valensi 5
2. Jenis ikatan
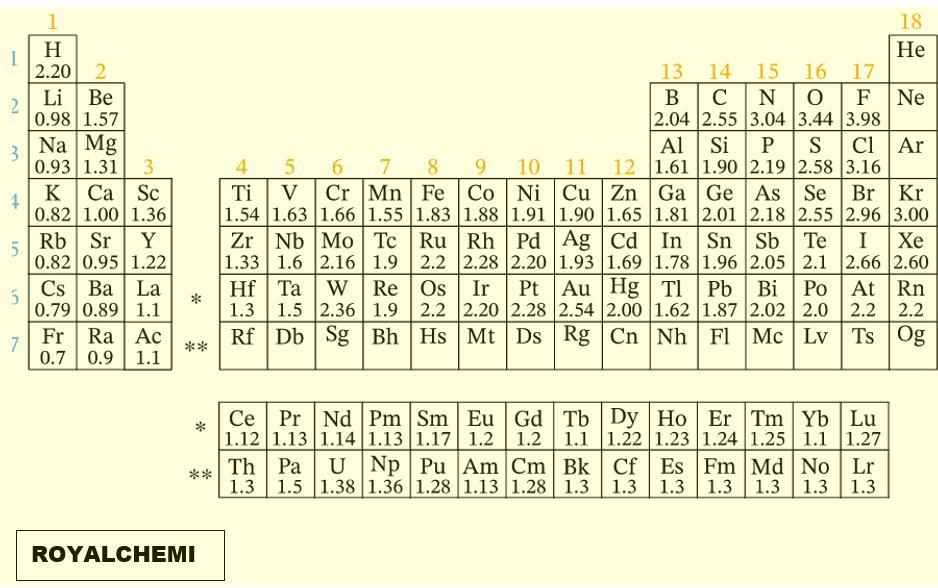
- Selisih elektronegativitas : (Cek Tabel pada lampiran)
C-H : 2.55 – 2.20 = 0.35 ==> kovalen non polar
C-N : 3.04 – 2.55 = 0.49 ==> kovalen non polar
N-H : 3.04 – 2.20 = 0.84 ==> kovalen polar - Ikatan antara C-H, N-H, dan H-N adalah ikatan kovalen.
3. Penentuan ikatan dan penggambaran
- Atom N dan C merupakan atom dengan kebutuhan elektron besar ==> dibuat ikatan dulu ==> ikatan kovalen non polar
- Kemudian, karena N masih perlu 2 elektron maka perlu mengikat 2 elektron dari 2 unsur H. (N ikut oktet dan H ikut duplet). Adapun C kurang 3 elektron, maka perlu mengikat 3 elektron dari 3 unsur H. (C ikut oktet dan H ikut duplet).
Pelajari lebih lanjut
- Materi tentang struktur lewis BeCl₂:
- Materi tentang definisi struktur lewis :
- Materi tentang struktur lewis unsur S :
______________
Detail jawaban
Kelas : X
Mapel : Kimia
Bab : Ikatan kimia
Kode : 10.7.4
#SolusiBrainlyCommunity
Bantu jawab kimia dengan caranya
Terima kasih

Kimia, Sekolah Menengah Atas
Jawaban:
jawabannya ada di gambar semoga membantu ya
13,5 gram unsur x bereaksi dengan unsur oksigen membentuk 49,5 gramxo2.jika 15 gram unsur x bereaksi dengan unsur kalsium akan terbentuk ca2x.berapakah massa ca2x ? (ar o = 16, ca=40)…
Kimia, Sekolah Menengah Pertama
Sebanyak 13,5 gram unsur X bereaksi dengan unsur oksigen membentuk 49,5 gram XO₂. Jika 15 gram unsur X bereaksi dengan unsur kalsium akan terbentuk Ca₂X. Massa Ca₂X adalah 115 gram.
Pendahuluan
Konsep mol adalah metode yang umumnya digunakan untuk menyatakan jumlah suatu zat. Untuk mengetahui nilai mol suatu unsur yang diketahui Ar-nya dapat digunakan persamaan berikut :
dengan Ar = berat relatif unsur (g/mol) dan massa dalam gram.
Penjelasan dengan langkah-langkah
Diketahui :
- Reaksi pembentukan XO₂
m X 1 = 13.5 gram
m XO₂ = 49.5 gram - Reaksi pembentukan Ca₂X
m X 2 = 15 gram - Ar O = 16 g/mol
- Ar Ca = 40 g/mol
Ditanyakan:
m Ca₂X = ?
Penyelesaian:
Ionisasi XO₂
Ionisasi Ca₂O
Hitung mol oksigen
- Hukum kekekalan massa
massa sebelum reaksi = massa setelah reaksi
massa oksigen + massa X = massa XO₂
massa oksigen + 13.5 g = 49.5 g
massa oksigen = 36 g - mol oksigen = massa oksigen : Ar O
mol oksigen = 36 g : 16 g/mol
mol oksigen = 2.25 mol
Hitung Ar X
- mol X = (koef X⁴⁺ : koef O²⁻) x mol oksigen
mol X = (1 : 2) x 2.25 mol
mol X = 1.125 mol - Ar X = massa X 1 : mol X
Ar X = 13.5 : 1.125 = 12 g/mol
Hitung massa Ca₂X
- mol X pada reaksi 2 = massa X 2 : Ar X
mol X pada reaksi 2 = 15 : 12 = 1.25 mol - mol Ca₂X = mol X
mol Ca₂X = 1.25 mol - massa Ca₂X = mol Ca₂X x Mr Ca₂X
massa Ca₂X = 1.25 mol x (2 x Ar Ca + Ar X)
massa Ca₂X = 1.25 mol x (2 x 40 + 12) g/mol
massa Ca₂X = 115 gram
Kesimpulan :
Massa Ca₂X terbentuk adalah 115 gram.
Pelajari lebih lanjut
- Materi tentang persamaan-persamaan dalam konsep mol :
- Materi tentang perhitungan mol HCl dalam larutan :
- Materi tentang perhitungan Mr :
_____________
Detail jawaban
Mapel : Kimia
Kelas : X
Bab : Stoikiometri
Kode : 10.7.7
#SolusiBrainlyCommunity



