
Tolong bantu ya pren

Mapel Kimia, Jenjang Sekolah Menengah Atas
Jawaban:
Ca₃(PO₄)₂ → Ca²⁺ + PO₄³⁻
Semoga Bermanfaat ya
Daftar Isi
Pertanyaan Baru di Kimia
Berapa ph dari larutan [hcl] dengan kosentrasi 1 x 10-3 m?
Kimia, Sekolah Menengah Pertama
pH dari larutan HCl dengan konsentrasi 1 × 10-³ M tersebut adalah 3.
DIKETAHUI
- M HCl = 1 × 10-³ M.
- a = 1.
DITANYAKAN
- pH = ..?
HCl termasuk asam kuat, sehingga konsentrasi [H+] dapat dihitung sebagai berikut:
Besar pH HCl pada konsentrasi itu:
PELAJARI LEBIH LANJUT
- Materi tentang menghitung pH asam kuat
- Materi tentang menghitung pH asam kuat
- Materi tentang menghitung pH asam kuat
DETAIL JAWABAN
- Kelas : 11
- Mapel : Kimia
- Materi : Larutan Asam Basa
- Kode Kategorisasi : 11.7.5
- Kata kunci : pH, HCl, pH asam kuat, konsentrasi [H+], pH larutan HCl.
Jawaban:
Dik : Ma = 1 × 10⁻³ M
Dit : pH
Jawab :
HCl = H⁺ + Cl⁻
[H⁺] = Ma × a
[H⁺] = Konsentasi ion H⁺
Ma = Molaritas / Konsentrasi senyawa Asam
a = Jumlah ion H
Maka =
[H⁺] = 1×10⁻³ × 1
[H⁺] = 10⁻³
Lalu mencari pH itu menggunakan Rumus :
pH = -log [H⁺]
= -log 10⁻³
= 3
Jadi, pH yang di dapatkan ialah 3
Penjelasan:
Semoga Bermanfaat, Terima Kasih
mohon bantuannya teman teman, disertakan dengan penjelasan nya ya. tolong jangan bercanda.. terimakasih banyak

Kimia, Sekolah Menengah Pertama
Jawaban:
Zat P = KBr
Zat Q = HCl
Zat R = Asam Cuka (CH₃COOH)
Zat S = Gula
Penjelasan:
- Pada Zat P itu KBr dimana itu merupakan campuran garam yang memilki sifat kuat yakni Logam KOH dan larutan HBr yang tentunya campuran larutan tersebut sifat elektrolitnya sangat kuat ketika di uji larutan tersebut elektroda tersebut memiliki banyak gelembung dan lampu tersebut menyala
- Pada Zat Q itu HCl dimana itu adalah asam kuat yang sifat larutannnya itu elekrolit kuat sehingga ketika di uji larutan memilki banyak gelembung dan lampu nya menyala
- Pada zat R itu Asam Cuka dimana itu adalah asam lemah yang memilki sifat larutan elektrolit lemah sehingga ketika di uji larutan tersebut memiliki sedikit gelembung dan lampunya tidak menyala
- Pada zat S itu Gula dimana larutan gula itu sifatnta laritannya non elektrolit sehingga ketika di uji larutan tersebut tidak memilki gelembung dan lampu tidak menyala
Gambar struktur Lewis dari senyawa CH3NH2
Kimia, Sekolah Menengah Atas
Gambar struktur Lewis dari senyawa CH₃NH₂ adalah
Pendahuluan
Struktur Lewis merupakan diagram yang menggambarkan ikatan kimia antara atom dalam suatu molekul. Struktur itu juga menampilkan jumlah total pasangan elektron yang ada di masing-masing atom yang membentuk molekul. Dalam struktur Lewis, setiap titik mewakili elektron dan sepasang titik di antara simbol unsur/atom mewakili ikatan.
Jenis ikatan kimia antar atom dan hubungannya dengan selisih elektronegativitas antar atom :
Terkait kestabilan konfigurasi elektron :
- Aturan oktet menyatakan bahwa unsur-unsur kimia yang berikatan cenderung memiliki delapan elektron dalam kulit terluarnya (mengikuti gas mulia yang stabil).
- Aturan duplet menyatakan bahwa unsur-unsur kimia yang berikatan cenderung memiliki dua elektron dalam kulit terluarnya (mengikuti gas mulia He yang stabil).
Pembahasan
1. Elektron valensi masing-masing unsur
- Dari tabel periodik unsur :
Nomor atom C = 6
Nomor atom H = 1
Nomor atom N = 7 - Elektron valensi unsur :
C = 2.4 ==> elektron valensi 4
H = 1 ==> elektron valensi 1
N = 2.5 ==> elektron valensi 5
2. Jenis ikatan
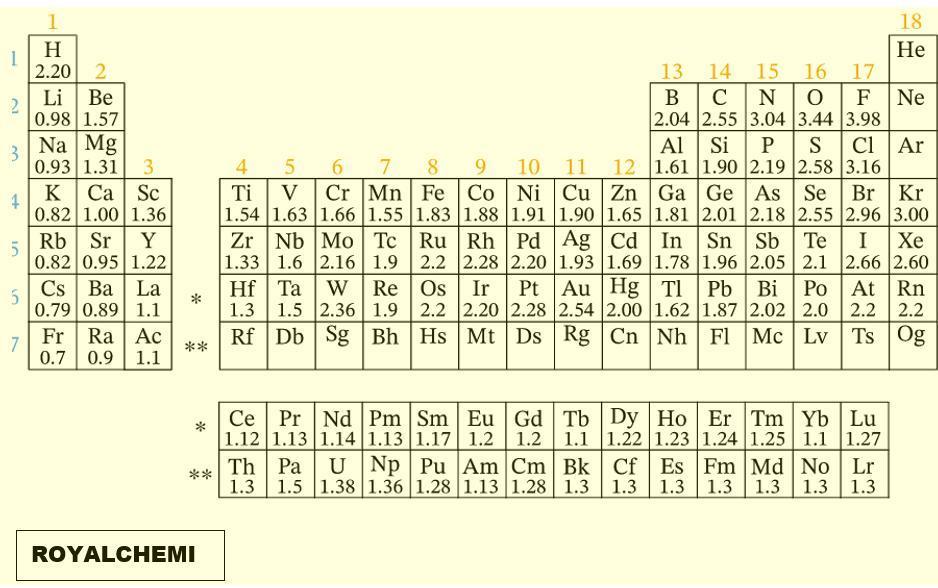
- Selisih elektronegativitas : (Cek Tabel pada lampiran)
C-H : 2.55 – 2.20 = 0.35 ==> kovalen non polar
C-N : 3.04 – 2.55 = 0.49 ==> kovalen non polar
N-H : 3.04 – 2.20 = 0.84 ==> kovalen polar - Ikatan antara C-H, N-H, dan H-N adalah ikatan kovalen.
3. Penentuan ikatan dan penggambaran
- Atom N dan C merupakan atom dengan kebutuhan elektron besar ==> dibuat ikatan dulu ==> ikatan kovalen non polar
- Kemudian, karena N masih perlu 2 elektron maka perlu mengikat 2 elektron dari 2 unsur H. (N ikut oktet dan H ikut duplet). Adapun C kurang 3 elektron, maka perlu mengikat 3 elektron dari 3 unsur H. (C ikut oktet dan H ikut duplet).
Pelajari lebih lanjut
- Materi tentang struktur lewis BeCl₂:
- Materi tentang definisi struktur lewis :
- Materi tentang struktur lewis unsur S :
______________
Detail jawaban
Kelas : X
Mapel : Kimia
Bab : Ikatan kimia
Kode : 10.7.4
#SolusiBrainlyCommunity
Tuliskan rumus empiris senyawa untuk rumus molekul berikut : a.H2C2O4 b.C5H10O5
c.CH3OH
d.C12H22O
Kimia, Sekolah Menengah Atas
Rumus empiris senyawa untuk rumus molekul berikut :
a.H₂C₂O₄ | b.C₅H₁₀O₅
c.CH₃OH | d.C₁₂H₂₂O
adalah
a. HCO₂
b. CH₂O
c. CH₄O
d. C₁₂H₂₂O
Pendahuluan
Awalnya, rumus kimia diperoleh dengan penentuan massa semua elemen yang digabungkan untuk membentuk molekul dan selanjutnya ditemukanlah dua jenis rumus penting dalam kimia: rumus molekul dan rumus empiris.
Rumus empiris suatu senyawa menunjukkan rasio paling sederhana dari jumlah unsur (berbeda) yang ada dalam molekul. Sedangkan rumus molekul mengunjukkan jumlah sebenarnya dari setiap unsur (berbeda) yang ada dalam suatu molekul. Rumus molekul merupakan kelipatan dari rumus empiris.
Pembahasan
a. H₂C₂O₄
atom H : atom C : atom O = 2 : 2 : 4
ketika unsur jumlahnya dibagi 2 agar membentuk perbandingan bilangan bulat paling sederhana :
atom H : atom C : atom O = 1 : 1 : 2
Jadi rumus empirisnya :
HCO₂
b. C₅H₁₀O₅
atom C : atom H : atom O = 5 : 10 : 5
ketika unsur jumlahnya dibagi 5 agar membentuk perbandingan bilangan bulat paling sederhana :
atom C : atom H : atom O = 1 : 2 : 1
Jadi rumus empirisnya :
CH₂O
c. CH₃OH
atom H : atom C : atom O = 4 : 1 : 1
Karena 1 adalah bilangan bulat paling sederhana, maka rumus molekul = rumus empirisnya.
Jadi rumus empirisnya :
CH₃OH
d. C₁₂H₂₂O
atom H : atom C : atom O = 22 : 12 : 1
Karena 1 adalah bilangan bulat paling sederhana, maka rumus molekul = rumus empirisnya.
Jadi rumus empirisnya :
C₁₂H₂₂O
Pelajari lebih lanjut
- Materi tentang rumus empiris dan rumus molekul :
- Materi tentang penentuan rumus molekul senyawa karbon :
- Materi tentang penentuan rumus molekul dari CxHyOz :
_____________
Detail jawaban
Mapel : Kimia
Kelas : XII
Bab : Senyawa karbon dan reaksi identifikasi
Kode : 12.7.8
#SolusiBrainlyCommunity
Kombinasi karbondioksida dan air untuk membentuk gula menghasilkan kelebihan
Kimia, Sekolah Menengah Atas
Kombinasi karbondioksida dan air untuk membentuk gula menghasilkan kelebihan gas oksigen.
Pendahuluan
Fotosinteis merupakan suatu proses yang dilakukan oleh tumbuhan, alga, dan beberapa jenis bakteri, dengan cara menangkap energi panas dari sinar matahari untuk menghasilkan oksigen (O₂) dan energi kimia yang disimpan dalam bentuk glukosa (C₆H₁₂O₆). Herbivora kemudian memperoleh energi ini dengan memakan tumbuhan, dan karnivora memperolehnya dengan memakan herbivora.
Pembahasan
Selama fotosintesis, tanaman mengambil karbon dioksida (CO₂) dan air (H₂O) dari udara dan tanah. Di dalam sel tumbuhan, air teroksidasi (berarti melepas elektron), sedangkan gas karbon dioksida mengalami reduksi (memperoleh elektron dari air). Hal ini menyebabkan air berubah menjadi oksigen dan karbon dioksida menjadi glukosa. Tanaman kemudian melepaskan oksigen kembali ke udara, dan menyimpan energi dalam molekul glukosa. Reaksi fotosintesis :
Pelajari lebih lanjut
- Materi tentang reaksi senyawa karbon :
- Materi tentang reaktan dan produk dari fotosintesis :
- Materi tentang proses-proses fotosintesis:
______________
Detail jawaban
Mapel : Kimia
Kelas : XII
Bab : Reaksi Kimia Organik
Kode : 12.7.7
#SolusiBrainlyCommunity



