Kristal karbon terdapat dalam bentuk grafit dan intan. A.Disebut apakah perbedaan bentuk pada unsur yang sama?
B.Apakah kegunaan intan? Jelaskan
Jawab A dan B
Mapel Kimia, Jenjang Sekolah Menengah Atas
Jawaban:
A. Alotrop
B. Perhiasan, sebagai bahan khusus untuk alat memotong kaca
Penjelasan:
karbon dan intan sama2 tersusun atas atom karbon, namun perbedaannya terdapat pada bentuk strukturnya. intan memiliki struktur yang teratur(kristal) sedangkan grafit memiliki struktur tidak teratur(amorf)
Daftar Isi
Pertanyaan Baru di Kimia
Apabila lelehan magnesium klorida dielektrolisis digunakan arus sebanyak 1 Faraday, maka logam magnesium yang dihasilkan sebanyak …. ( Ar Mg =24 ) A
6 gram
B
24 gram
C
2,4 gram
D
12 gram
E
4,8 gram
Kimia, Sekolah Menengah Atas
Jawaban:
D.
Penjelasan:
Elektrolisis: Lelehan MgCl2
katode : Mg^2+ + 2e => Mg
Artinya 1 mol Mg = 2 mol e
Rumus: massa logam ( w ) = e . F
dimana e = Ar / mol e
e = 24 / 2
e = 12
berarti w = 12 . 1 F = 12 g
100 gram C3H8 direaksikan sempurna dengan 100 gram O2, hitung jumlah massa gas-gas hasil reaksi. Bila Ar C=12, H=1, O= 16 (gram/mol)
Kimia, Sekolah Menengah Atas
Jawaban:
massa CO2 : 83,16 gram
massa H2O : 45,36 gram
Penjelasan:
pembakaran hidrokarbon selalu menghasilkan CO2 dan H2O
C3H8 + O2 —–> CO2 + H2O
setarakan reaksinya sehingga menjadi
C3H8 + 5O2 —-> 3CO2 + 4H2O
hitung mol mula-mula masing2 pereaksi
mol : massa/Mr
mol C3H8 : 100/44 = 2,27 mol
mol O2 : 100/32 = 3,13 mol
C3H8 + 5O2 ——> 3CO2 + 4H2O
m 2,27. 3,13
b. 0,63 3,13. 1,89. 2,52
s. 1,64. -. 1,89. 2,52
sehingga mol CO2 dan H2O yang dihasilkan berturut2 adalah 1,89 dan 2,52 mol
massa CO2:
massa = mol . Mr
= 1,89 . 44
= 83,16 gram
massa H2O
massa = mol . Mr
= 2,52 . 18
= 45,36 gram
kalo benar kasih jawaban terbaik, kalo salah komen:)
Massa 5 mol fecl3 dengan jika ar fe= 56 dan cl = 35.5 adalah
Kimia, Sekolah Menengah Pertama
Penjelasan:
g=mol×mr
g=5×(56+3(35.5))
g=812,5 gram
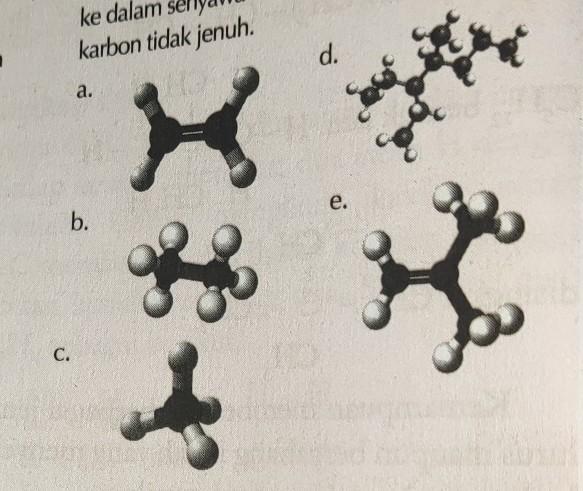
Kelompokkan struktur senyawa karbon berikut ke dalam senyawa karbon jenuh atau senyawa karbon tidak jenuh.
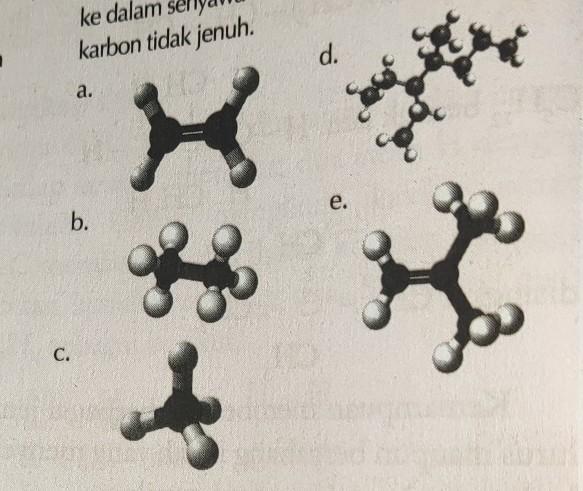
Kimia, Sekolah Menengah Atas
Penjelasan:
penentuan senyawa karbon jenuh dan tak jenuh ditentukan berdasarkan ikatan yang ada di dalam strukturnya. apabila hanya memiliki ikatan tunggal (alkana) maka disebut senyawa karbon jenuh. sedangkan apabila memiliki ikatan rangkap (alkena dan alkuna) maka disebut senyawa karbon tak jenuh.
pada gambar, senyawa a dan e memiliki ikatan rangkap sehingga disebut senyawa karbon tak jenuh
sedangkan b,c, dan d hanya memiliki ikatan tunggal maka disebut senyawa karbon jenuh
Hitunglah mol dari 1,8.10.²³ NaCL
Kimia, Sekolah Menengah Atas
Jawaban:
0,3 mol
Penjelasan:
Jumlah partikel = mol x 6×10^23
dimana 6×10^23 adalah tetapan bilangan Avogadro
berarti mol NaCl = 1,8×10^23 / 6×10^23 = 0,3 mol



